
撰文:高子陽、Verdi
突破技術
這是人體中各種細胞類型的完全目錄。
重要意義
超精確的人類生理學模型將加速新藥的研發與試驗。
技術成熟期
5年
主要研究者
-布羅德研究所(Broad Institute)
-桑格研究所(Sanger Institute)
-陳-扎克伯格的Biohub(Chan Zuckerberg Biohub)
當你凝視腳下的方寸土地,是否曾經好奇過生命的起源?鷹擊長空,魚翔淺底,萬類霜天競自由,這一切都源於35億年前混沌海洋中的生命微光。當時的地球表面遍佈著頻繁活動的火山,向外不斷地噴吐出火山灰和岩漿;空氣中的一氧化碳和氫氣在電離子風暴的作用下形成了簡單的有機物,這些物質在原始海洋中不斷地堆積,在洪荒之初發生了複雜的化學反應,構成了生物大分子,逐漸演變成最初的生命。
昔日原始海洋中的滄海一粟,是如何變成今日的勃勃生機的呢?通過化石記錄的證據,我們可以確定生命起源於35億年前的原核細胞生物。在生命出現後的最初的15億年間,原核細胞是唯一的生命形式,它們個體渺小但數量巨大,有些通過光合作用產生氧氣,徹頭徹尾地改變了地球的模樣。原核細胞並沒有細胞核,構成其核物質的是直接與細胞質接觸的單個染色體。我們熟悉的藍藻、各類細菌都是原核生物,構成這種古老生命形式的原核細胞,依舊滲透在我們生活的每一個部分。
大約在21億年前,原始海洋中的有機物逐漸被消耗殆盡,大氣中積攢了部分原核生物通過光合作用產生的氧氣,原始海洋中逐漸演化出真核細胞。與原核細胞不同的是,真核細胞的內部具有核膜包被的細胞核。最初的真核細胞是單細胞的真核生物,又叫原生動物,僅一個小小的細胞就具有完整的生命代謝體系。後來,細胞之間產生了分工與合作,不同的細胞各司其職,進化出了多細胞生物。植物、動物、真菌等均屬於多細胞的真核生物。
與細胞的漫長進化史相比,人類在地球上生活的時間可謂流光瞬息。儘管我們使用高級的工具改變了地球的環境,建立了發達的文明,但人類的本質是一種靈長目人科人屬的直立行走物種。人類是多細胞生物,人體內的細胞之間相互協作,通過發生驚人的化學反應,使我們的生命得以延續。
而我們在很長的一段時間內,對此一無所知。
人類對細胞的認識,起源於400年前。
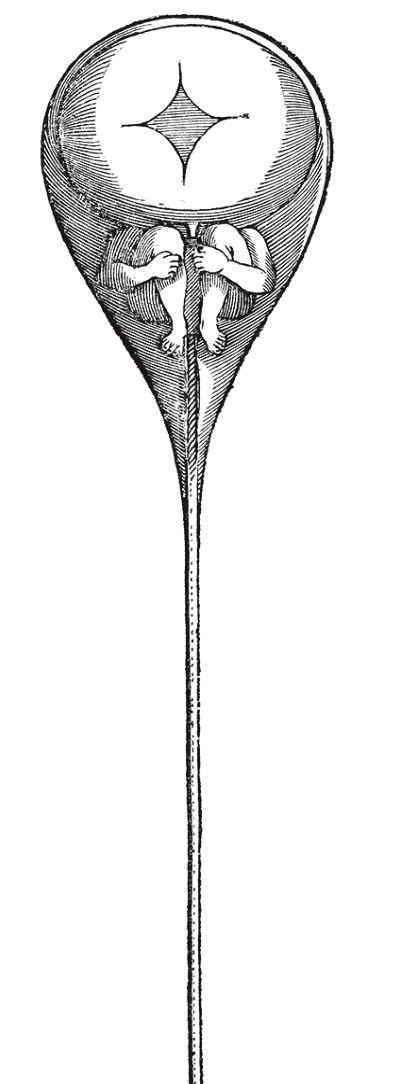
人們假想的含有「小矮人」的精子(Nicholas
Hartsoeker,1695年)

Robert Hooke通過顯微鏡看到並畫下了軟木栓細胞(1665年)
1665年,羅伯特·胡克使用自製的光學顯微鏡觀察軟木薄片時,觀察到了像修道院的房子一般的一個個小隔間。於是他使用表達單人間意思的cell一詞將植物細胞命名為cellular。儘管胡克觀察到的細胞早已死亡,其結構實為死亡後的植物細胞壁,但胡克仍然被認為是第一個描述細胞結構的科學家[1]。在羅伯特·胡克觀察到死細胞後不久,1674年,荷蘭科學家列文虎克利用手工自製的顯微鏡,首次觀察到了雨水中活動的單細胞生物,這是人類歷史上第一次成功地觀察並描述了活細胞[2]。
19世紀初期,隨著植物解剖學的發展,法國科學家Charles Milbel認識到植物的每一個部分都有細胞存在。隨著種種觀察的累積,1838年法國科學家施萊登宣佈細胞是一切植物的基本活體單位,是一切植物發展的根本實體。1839年,施旺將此學說擴大到動物界,如此便構成了人們所熟知的細胞學說:細胞是動物和植物生命活動的基本單元。恩格斯將細胞學說譽為19世紀的三大發現之一,是整個現代生物學的理論基礎[3]。
隨後的200年中,科學家對細胞學說進行了不斷的改進和糾正,逐漸發展為現代細胞學說。現代細胞學說主要分為三點:1.細胞是一個有機體,一切動植物都由細胞發育而來,並由細胞和細胞產物所構成;2.細胞是一個相對獨立的單位,既有自己的生命活動,又對其他細胞和其他細胞共同組成的生命整體起作用;3.新的細胞是從以前存活的細胞中產生的。
1873年,意大利組織解剖學家高爾基發明了「高爾基銀染法」,使得人們可以看到完整的神經細胞。1887年,西班牙畫家拉蒙·卡哈爾利用此方法對小腦和視網膜進行觀察,並通過其出色的繪畫才能,精確地呈現出他的研究結果。卡哈爾觀察到小腦中的不同的神經細胞通過突起的方式相互勾連,但並不直接連接[4]。1889年,卡哈爾發表了自己的研究成果,他提出大腦是由相互獨立的神經細胞所構成,它們之間並不構成直接相連的網狀系統。這便是神經元學說的基本內容。
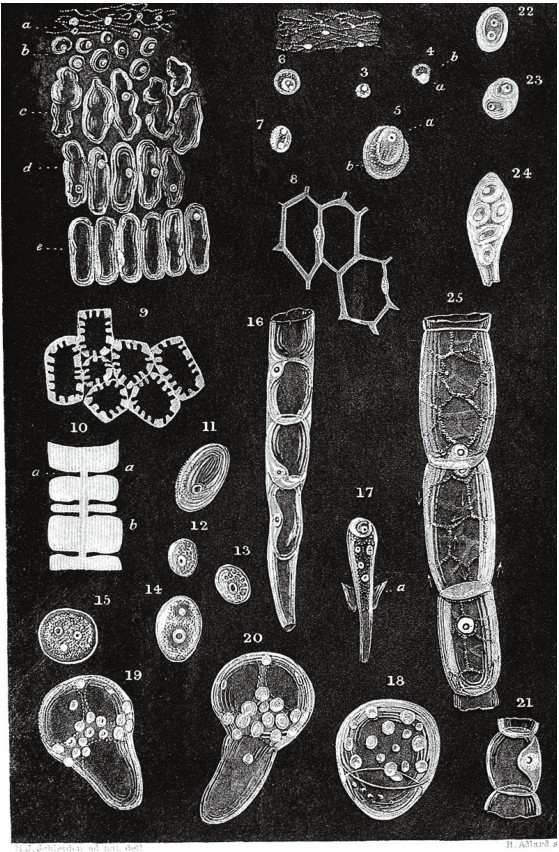
植物細胞(J.M.Schleiden,1838年)
此外,卡哈爾發現神經細胞並不是一模一樣的,於是他通過其畫作展示了人腦中不同的神經細胞類型,如錐體細胞、浦肯野神經元等。在卡哈爾筆下的視網膜結構圖中,他將視網膜分為10層,每層由不同種類的細胞組成。卡哈爾認為B、C、D層的感光細胞將光線轉換成電信號,之後傳導至其他細胞層,最終傳導至大腦。1906年,瑞典卡羅琳斯卡醫學院將諾貝爾生理學或醫學獎授予在神經組織學領域做出重要貢獻的高爾基和卡哈爾。
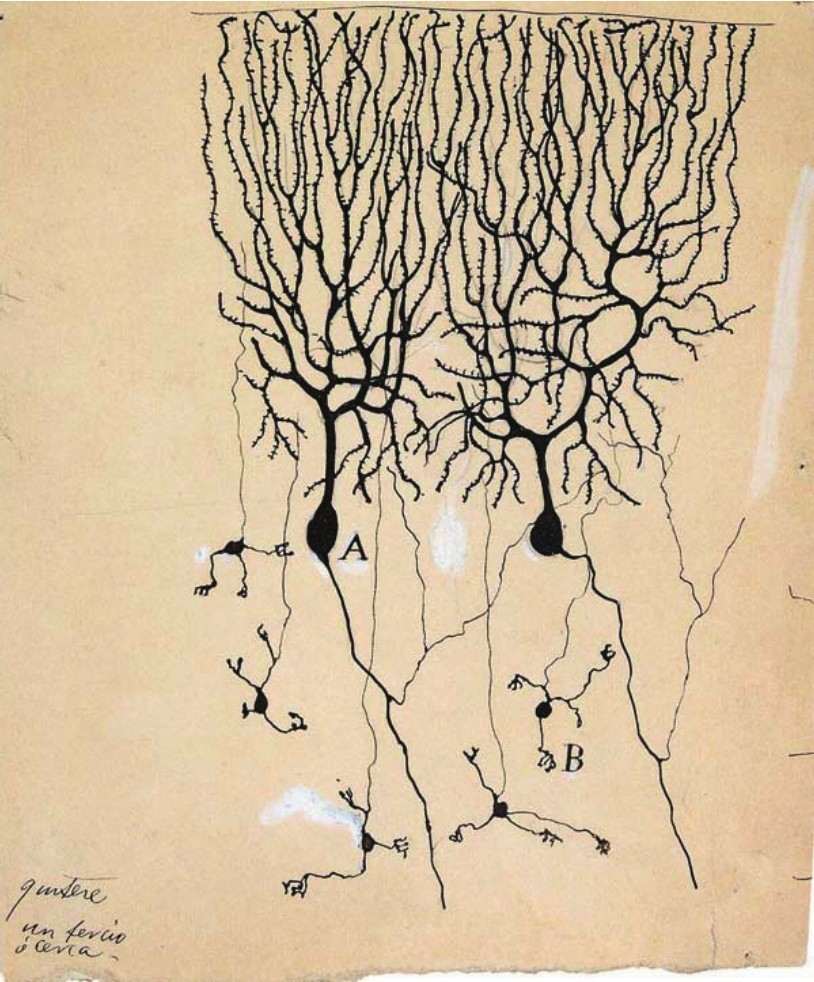
神經細胞(Roman y Cajal)
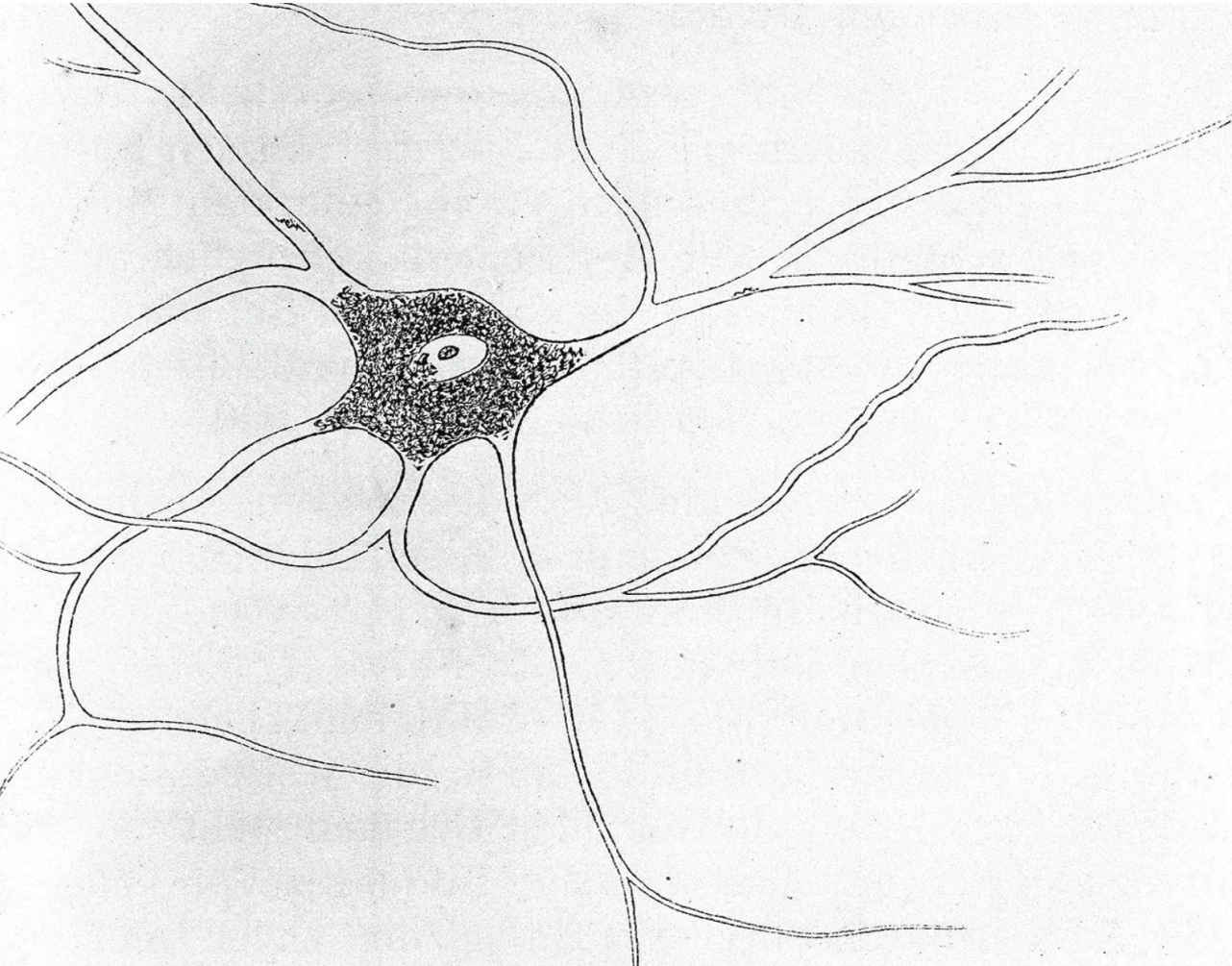
今天,在卡哈爾繪製精細的細胞圖譜100年後,我們已經知道,除紅細胞外,人體內擁有總數超過1萬億的細胞。它們分佈於人體的每一個部分,行使各自不同的功能,構成了精妙絕倫的人體結構,每時每刻滿足著新陳代謝的需要。目前人們對細胞分類的標準主要是基於細胞的形態、基因表達和功能的差異,細胞的空間分佈、分化狀態和譜系追蹤對於細胞分類起著輔助的作用。近年來,隨著表觀遺傳學研究的深入,表觀遺傳譜也成為細胞分類學關注的重點。如果只進行粗略的分類,人體內大概有300種細胞類型。但是如果進行精細的劃分,光是視網膜神經元就有100多種細胞類型,由此可見人體內的細胞構成極其複雜。
神經細胞(A.von Kolliker,1852年)
拿人體內最大的器官——皮膚為例。看似簡單的皮膚組織,實際上是由許多種細胞組成的。人類的皮膚分為表皮和真皮兩層,被表皮基底層分隔開。表皮是皮膚的最外層,是人身體的保護層,具有維持水分、避免病原菌進入體內的功能;皮膚表皮中具有柱狀上皮細胞、黑色素細胞、角質細胞、扁平細胞等細胞[5]。真皮是位於表皮以下的組織,由緻密的結締組織組成,其中含有大量的成纖維細胞、肥大細胞、組織細胞、淋巴細胞、噬黑色素細胞、朗格漢斯細胞及少量的真皮樹突狀細胞[6]。
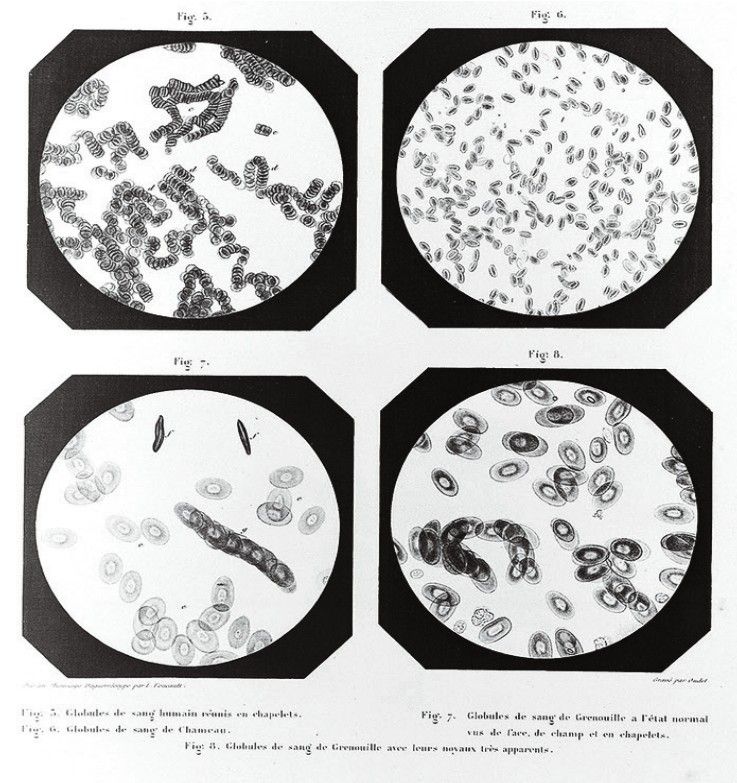
人類、駱駝和蟾蜍的血液細胞Daguerreotypes(A.Donne,1845年)
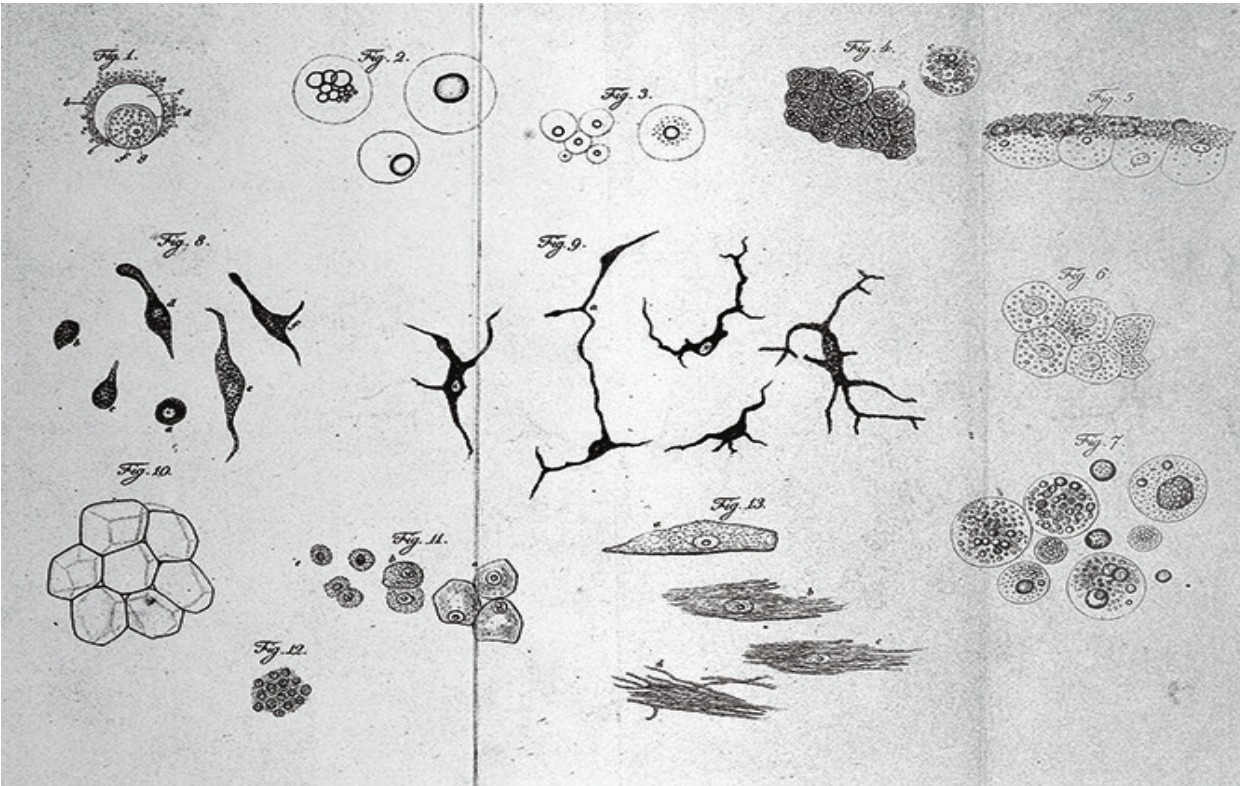
動物細胞草圖(Theodor Schwann,1839年)
皮膚擁有很強的修復和再生能力,這是由於皮膚中的皮膚干細胞在起作用。目前研究比較多的是表皮干細胞和毛囊干細胞。表皮干細胞是各類表皮細胞的祖細胞,可以向下遷移分化成表皮基底層,進而發育為毛囊,也可以向上遷移,最終分化為各類表皮細胞[7]。僅僅皮膚干細胞的類型就有很多。在胚胎時期,皮膚是由在毛囊形成過程中不同的細胞類型所構成的。科學家們通過對胚胎皮膚毛囊祖細胞進行轉錄組圖譜的分析,鑒定出簡單的毛囊祖細胞可以被分為6種類型,它們在細胞黏附、細胞遷移、上皮發育等過程中都扮演著各自不同的角色[11]。表皮干細胞可以被不同的生物標記物區分為6種類型,它們呈片狀分佈在表皮基底層[8]。
成纖維細胞是一種合成細胞外基質和膠原蛋白的細胞,是生物結締組織的基本構造,為結締組織提供框架結構,對皮膚的傷口癒合有著重要作用[9]。看似簡單的成纖維細胞也各自不同,可以根據其發育的不同階段分為7種類型,每種成纖維細胞的形態各異,其所處位置和活動性決定了細胞的形態[10]。
另外,人類皮膚中還包含廣泛的免疫細胞網絡,是皮膚免疫屏障的關鍵。人們利用皮膚免疫細胞的細胞圖譜分析,發現了皮膚免疫細胞的功能、位置的異質性。一些特殊類型的T細胞僅分佈於耳周皮膚,具有不同免疫應答功能的肥大細胞也具有不同的數量[12]。
再拿卡哈爾研究過的視網膜舉個例子。視網膜是脊椎動物和一些頭足綱動物眼球後部的一層非常薄的細胞,行使將光信號轉化為神經信號的功能。它的結構清晰明瞭,是很多科學家喜愛的研究對象。人類的視網膜由外到內分為10層,每層都由特異的細胞構成。以往估計人體內總共有300多種細胞,而現在人們發現單單一層薄薄的視網膜就可能含有100多種神經細胞。通過對轉錄組的分析,研究者發現了幾十年的眼部研究都沒能發現的兩種新類型的視網膜細胞。
簡單的視網膜細胞種類就已經大大超出了人們的想像,更不用說複雜的人腦了。人腦中同樣具有高度異質的細胞類型,主要包括神經元和神經膠質細胞。神經膠質細胞中的寡突膠質細胞從轉錄組就能分出多於12種的類型。神經元細胞在轉錄組層面具有高度異質性,即使是形態無差異的神經元,其中的蛋白表達也存在著很大的變化。
這些例子告訴我們,傳統的基於細胞形態的分類學對於細胞類別的鑒定僅停留在表面階段,人類對構成自己身體的細胞的種類瞭解甚少。作為第一個描述細胞的科學家,胡克將會被生物學的下一個大型項目震驚到:這是一個使用現代基因組學和細胞生物學中最強大的工具來單獨捕獲和端詳數百萬個細胞的計劃。
這個項目的目標是構建第一個全面的細胞分類系統——「細胞圖譜」或者「人類細胞地圖」。這個項目的實現將成為一個技術奇跡,因為它將首次全面揭示人體是由什麼組成的,並為科學家們提供一個新的複雜的生物學模型,以提升藥物研發的速度。
這項研究主要面臨著兩個挑戰。一是細胞分類的準確性。細胞分類系統需要能夠定義絕對單一的細胞類型,而不是定義一個具有多種細胞類型的亞群。二是細胞分類的全面性。我們需要的是一個能夠保證最終鑒定出所有細胞類型的分類系統,這同樣要求我們能夠找到所有的細胞類型[13]。
為了實行這個解碼人體37.2萬億個細胞的任務,由來自美國、英國、瑞典、以色列、荷蘭和日本的國際科學家組成的聯合會正在分配任務,包括檢測每種細胞的分子特徵,並給每種細胞一個在人體空間中特定的「郵政編碼」。「我們將會看到我們所期望的東西、我們已知存在的東西,但我確信除此之外我們還會發現全新的事物。」英國桑格研究所的細胞圖譜團隊負責人Mike Stubbington說,「我認為會有驚喜出現。」
這個新項目的研究主要運用了3種技術:單細胞捕獲技術、測序技術和多種全新的標記和染色技術。前兩項技術通常一起討論,稱為「單細胞測序技術」。
單細胞測序技術
單細胞RNA(核糖核酸)測序是細胞圖譜計劃的核心技術,能夠提供單個細胞的基因組圖譜。而且目前大量的與之相配的技術,如微流控等使單細胞測序成為一種低成本、高通量的測序方式[14,15]。
在單細胞RNA測序技術出現之前,人們普遍利用分子探針型技術對單細胞進行m RNA(信使核糖核酸)圖譜的分析。常見技術主要有螢光融合報告蛋白、定量實時聚合酶鏈式反應(q RT-PCR)、原位螢光雜交 (FISH)和基因芯片技術[19]。這些技術在一定層面上可以反映細胞中的一些基因的表達變化,但由於它們都是依賴於分子探針的技術,並不能夠反映出全基因組的轉錄組水平,空間分辨率較低,具有一定的局限性。
單細胞RNA測序是一種不需依賴分子探針的技術,它將細胞內的RNA分子反轉錄成c DNA (互補脫氧核糖核酸),並隨之進行二代測序,能夠反映出全基因組層面的編碼和非編碼RNA轉錄水平,是反映特定環境中細胞狀態的絕佳方法。
單細胞RNA測序最早是由大規模(bulk) RNA測序演變而來的。對於大規模RNA測序而言,提取RNA時大概需要100萬個細胞。
而單細胞測序需要使用單細胞捕獲技術,對單個細胞進行裂解,然後測序[20]。2009年,M.Surani等人在《自然·方法》雜誌上發表了多聚A尾法的單細胞RNA測序方法,他們利用帶多聚T尾的引物對模板進行兩次擴增後得到c DNA,這項方法在後來的單細胞RNA測序研究中得到了非常廣泛的應用[21]。
近年來,單細胞RNA測序更是飛速發展:2012年,Gary Schroth和Richard Sandberg等人在《自然·生物》技術雜誌上發表了名為Smart-seq的單細胞測序方法,這項方法利用了模板轉移的技術,提高了轉錄過程的覆蓋度[22];2011年,James Eberwine等人將體外轉錄技術(IVT)用於單細胞RNA測序,實現了c DNA的線形擴增[23];同樣在2011年,Tung T.Hoang等人發表了滾動循環週期的單細胞RNA測序技術,這使得對原核生物(細菌、放線菌等)進行單細胞RNA測序成為可能[24];2012年,Peter Lonnerberg和Sten Linnarsson等人發明了一種對單細胞進行RNA 5』端測序的方法,這種方法滿足了對特定核酸鏈進行測序的需求[25];2012年,Itai Yanai等人發明了CEL-Seq的單細胞測序方法,通過匯聚標記過後的樣本,滿足了單細胞RNA的快速線形擴增[26];2013年,Gosta Winberg和Rickard Sandberg在Smart-Seq的基礎上進行了改進,推出了Smart-Seq2技術,在單細胞的反轉錄、模板轉移、預擴增方面都有了顯著的提高。與Smart-Seq相比,Smart-Seq2有著更精確的檢測靈敏度、更高的測序覆蓋率[34];2014年,來自Weizmann研究所的Ido Amit和Amos Tanay發明了一種自動化的高通量單細胞RNA測序的並行技術,能夠在數以千計的單細胞中分析轉錄組狀態。利用這項技術,人們可以從複雜的組織中測得廣泛的細胞組成類型[16]。
單細胞測序的流程主要分為單細胞捕獲、單細胞裂解、反轉錄、核酸擴增、建庫測序這5個步驟。單細胞捕獲是單細胞測序的第一步,這看似簡單的步驟實際上是整個測序過程中最具有挑戰性的一步。
目前,最常用的單細胞捕捉技術有微管吸吮技術、激光顯微切割、螢光活化細胞分選、微滴技術、微流體技術。微管吸吮技術採用開口極細的微型玻璃管,利用壓力將單個細胞從組織中捕獲,這是一種十分耗時的方法,被用於早期胚胎的單細胞捕獲。激光顯微切割是利用激光將組織薄片上的細胞進行分離的技術,同樣非常耗時,被用於基於細胞形態和細胞螢光標記的細胞分選。
為了提高細胞分選的效率,人們開始嘗試用高通量的方式。螢光活化細胞分選(FACS)是一種利用細胞表面的螢光標記對液滴中的單細胞進行分離的技術,其優點是高通量,且能夠利用特定免疫標記的細胞表面分子提高分選的準確性。但其缺點也很明顯,一是需要特定的抗體和分子標記,二是儀器的價格昂貴[29]。
微流體技術是利用微流體芯片在極窄的流體通道中將細胞進行分離的方法,它能夠分離總體積量很小的細胞,同樣是一種高通量的方法。Fludigm C1的微流體平台能夠利用流體回路對細胞進行捕捉,同時能用顯微鏡對這些細胞進行觀察,反轉錄和核酸擴增都自動緊隨細胞捕捉後進行。但是微流體技術要求細胞的大小基本一致,在處理黏性較高的非球體細胞時,效率也會降低。它同樣也是一種高成本的方法[30]。
激光顯微切割是一種在顯微鏡下利用激光將單個細胞從組織薄片中切除的技術,可以看作是一種物理分選,它能夠保留細胞的周圍信息。但是如此小範圍的精細切仍然是一個技術上的挑戰,而且激光切割過程中的紫外線可能會對細胞具有潛在的傷害[31]。目前並未有一種能適用於所有研究的單細胞分離方法,研究者需要根據其研究目的和樣本的種類選擇最適合實驗的方法。
2015年,一種叫作「細胞微流體」(Drop-Seq)的技術進入了人們的視線。Drop-Seq是一種從液滴中提取單個細胞進行轉錄組分析的方法[27]。它利用微流體裝置來區分轉錄後的單個細胞、裂解液和覆蓋著引物的微珠。這項技術分離單獨的細胞並用微珠標記,使其被油滴包裹後再進行研究和分析。選擇油滴的原因是油滴可以如同汽車一樣載著細胞,沿著被蝕刻在微小芯片上的狹窄的毛細管單向「街道」分流,使得細胞被聚集在特定的地方,裂解並逐一研究。細胞微流體是一種低成本高通量的測序方法,其成本大約為每個細胞7美分,是很多研究者的首選。但是它對於微流體設備的要求較高,對於不同的細胞需要特定種類的微流體設備來進行液滴的分離。另外Drop-Seq對於單個細胞的基因敏感度較低,且只能用於m RNA的反轉錄[28]。
單細胞分選的下一步是裂解細胞,然後對細胞中的多聚A尾RNA進行反轉錄處理。反轉錄時,我們以RNA為模板,利用多聚T的引物進行首鏈的合成,並且在合成的序列後添加上基因條形碼,以便後續的分析識別。次鏈的合成有c DNA合成和模板轉移擴增兩種方式,最終都可以得到雙鏈的DNA。

細胞微流體技術使用的微流體設備
再下一步是對反轉錄後的DNA進行核酸擴增。一種是利用聚合酶鏈式反應(PCR)的擴增方法,這是指數型的擴增;另一種是體外轉錄法,這種方法是線性的擴增,但需要對RNA進行多一輪的反轉錄。完成反轉錄後便可以對擴增後的DNA文庫進行測序。
單細胞RNA測序目前已被廣泛應用於檢測組織中的複雜的細胞種類、追蹤細胞譜系的來源、檢測細胞生理狀態等方面,大大助力於各項研究:2010年,來自劍橋大學的M.Surani對囊胚期中不同發育階段的細胞進行了單細胞RNA測序,發現了在這兩種狀態下細胞的轉錄水平存在巨大的差異,大多與對總體代謝有重大影響的分子有關[18];2016年,來自斯坦福大學的Marius Wernig和Stephen Quake利用單細胞RNA測序技術在不同的時間點對小鼠胚胎成纖維細胞到誘導神經細胞的重編碼過程進行了分析,解釋了細胞重編碼過程中分子的連續性。這項研究對於理解在分化過程中的細胞轉錄組狀態具有重要的意義[17]。
目前而言,單細胞RNA測序的技術已經被廣泛運用於真核生物的多聚A尾m RNA的轉錄組研究中,但是仍然有很多問題需要解決。比如在進行短序列測序時,很難同時做到維持核酸鏈的特異性和檢測各類亞型之間的差異。在測序過程中,RNA的丟失(50%~60%)會在很大程度上降低轉錄組分析的全面性[32]。單細胞RNA測序的敏感度同樣也是目前單細胞測序的不足之處,目前在低量的轉錄組中,很難辨別出技術噪聲和生物差異性之間的區別,這使得人們在研究整體的轉錄水平時會損失很大一部分信息[33]。此外,對於非真核細胞的單細胞測序研究,比如研究某些具有感染性的病原體,也需要人們在現有的單細胞測序技術上進行改進。
近些年關於單細胞RNA測序的研究使我們瞭解到,很多細胞層面的未解之謎只能通過單個細胞的研究來回答。我們可以想像,在不久的將來,當人們改進了這些技術性問題後,單細胞RNA測序的技術可以被用於所有類型的細胞轉錄組研究,人們也將揭示更多的單細胞層面上的未知問題。
單細胞RNA測序的另一個核心技術就是測序技術。測序是指通過物理或化學的方法確定線狀生物大分子初級結構的過程。DNA測序指分析特定DNA片段的鹼基序列,即腺嘌呤(A)、胸腺嘧啶(T)、胞嘧啶(C)和尿嘧啶(G)的排列方式。它是現代測序技術的核心,也是破解各種生物奧秘的關鍵。
20世紀中期,DNA測序技術剛剛起步,當時所流行的化學降解法、雙脫氧鏈終止法、螢光自動測序、雜交測序等被統稱為第一代測序。其中由Fred Sanger及其同事發明的雙脫氧終止法(又稱Sanger測序法)是第一代測序中最常被使用的技術。
雙脫氧終止法(Sanger測序法)的原理是DNA複製,起反應體系中包括目標DNA片段、脫氧三磷酸核甘酸(d NTP)、雙脫氧三磷酸核甘酸(dd NTP)、測序引物及DNA聚合酶等。由於dd NTP缺少3』-OH基團,不具有和另一個d NTP連接形成磷酸二脂鍵的能力,可以終止DNA鏈的延伸。通過在4個平行的測序反應中分別加入不同的dd NTP,DNA鏈會分別在A、G、C、T位終止,於是會形成不同長度的DNA片段。隨後通過聚丙烯酰胺凝膠電泳區分開長度相差為一個核甘酸的DNA分子,於是便可以讀出DNA序列[35]。
2000年,人類基因組計劃的草圖完成了。傳統的第一代測序已經不能滿足對大規模基因組進行測序的需求,此時新一代測序的技術在傳統科學和商業界的推動下應運而生。
第二代測序的核心技術是邊合成邊測序,即通過捕捉新合成的核酸末端的標記來確定DNA的序列,與Sanger測序法相比具有更快的測序速度。第二代測序技術最顯著的特徵是高通量,能夠一次性對上百萬條DNA進行測序,使DNA測序的成本降低到了以前的千分之一。採用大規模平行測序平台的第二代測序技術,打破了以往大型測序中心對測序產業的壟斷,使DNA測序費用降到了以往的百分之一。第二代測序技術的發展使人們能用低廉的價格更加全面地研究基因組、轉錄組、表觀遺傳等組學之間的關係。目前市面上主要的第二代測序平台有羅氏公司的454焦磷酸測序、Illumina公司的Hi Seq和Life Technologies公司的SOLi D。Illumina是單細胞RNA測序最常使用的平台,整個測序分為4個步驟:文庫制備、核酸簇生成、DNA片段測序、數據分析[36]。
近幾年來,第三代測序技術的發展勢頭十分猛烈,與第二代測序技術不同的是,第三代測序技術不需要進行PCR擴增。目前盛行的第三代測序技術有Helico Bio Science的單分子測序技術、Pacifc Bioscience的SMRT技術和Oxford的Nanopore(納米孔單分子測序)技術。Nanopore作為最常用的第三代測序技術,與其他利用「邊合成邊測序」原理的技術都不同。該公司利用一種經過特殊設計的納米孔,將核酸外切酶依附在孔的外表面,將一種合成的環糊精通過共價鍵安裝在孔的內表面,充當傳感器的角色。當DNA分子從孔中經過時,會使流經納米孔的電流強度發生變化,再利用靈敏的電子設備檢測到這些變化,從而鑒定出這些鹼基[37]。
對於測序而言,測序技術的應用只是其得到序列數據的一種方式,在得到數據後更重要的步驟是對這些數據進行分析且得出對實驗有用的結論。無論是大規模細胞還是單細胞的轉錄組測序,目前其分析的流程都大同小異。
第一步都是序列比對和瞭解片段的測序深度。所謂序列比對就是將測序後的結果與已有數據庫中的模板序列進行比對,再將與之匹配的模板序列的模板信息安置到測序後的序列上。第二步是要對比對後的序列進行質量控制,主要關注基因文庫的質量是否能夠滿足後續分析的需要;在單細胞RNA測序中,還需要關注單個細胞的RNA是否被降解。第三步是在確定得到質量過關的測序數據後,對測序的深度進行標準化處理,以確保在分析時不同批次的數據具有相近的測序深度。以上步驟我們稱之為測序數據的上游分析。
下游的分析在大規模細胞測序和單細胞測序中並無差異。首先我們需要對令人疑惑的因素進行分析,利用回歸分析的手段找出細胞或樣本之間的潛在差異。其次便可以用聚類分析的手段對細胞類型進行鑒定。最後利用差異表達分析工具分析不同細胞類別的特徵。得到了以上步驟的結果後,我們便可以進行更加複雜的分析和模型構建,如基因調控網絡分析、單細胞的轉錄動力學分析等[38]。
細胞圖譜的繪製不僅需要強大的單細胞測序技術,還需要依靠多種全新的標記和染色技術來明確特定細胞的空間坐標。近年來,激光顯微切割和原位螢光雜交技術也在趨於單細胞化,大大提高了空間分辨率。而組織透明化技術為在組織中精確定位細胞提供了可能。
如上文所說,激光顯微切割是一項自動化的樣本預處理技術,這項技術能夠在顯微鏡下從混合的細胞群體中分離出特定的細胞,而這種從複雜組織中分離純化單個細胞的技術能夠提高基因組分析的精確度。在顯微鏡下,通過細胞識別軟件的處理,組織薄片中的細胞可被單個區分開,因此可以運用超強脈衝激光對組織直接進行切割。
近年來,激光顯微切割技術的發展使激光切割的寬度能夠少於1微米,因此目標細胞不會被激光束所影響,甚至活細胞也不會被激光束的切割所損傷,在適當操作的情況下,激光切割後的細胞仍然可以被用來克隆或重新培養[39]。激光顯微切割技術常被用來從組織、血液甚至精子樣本中分離少量細胞或單個細胞。這些細胞能夠通過形態學、免疫組化染色、原位雜交的方法被選擇且確定位置。
目前,已有大量研究使用了激光切割技術。2012年,華盛頓大學的Allen Jones和愛丁堡大學的Seth Grant共同發表了他們關於人類大腦轉錄組學的細胞圖譜研究。他們將數字化的大腦分子圖譜集成的方法引用到了模式生物上,利用激光切割的方法篩選出目標樣本,發明了一種能夠在樣本中構建全面的轉錄組圖譜的技術[40]。2014年,Allen大腦研究所的John Hohmann和Ed Lein利用激光顯微切割技術,對妊娠中期的人類大腦樣本構建了全面的轉錄組圖譜,為人們瞭解大腦的發育過程提供了豐富的信息資源[41]。2014年,瑞典卡洛琳斯卡研究院的Carlos Ibanez和Sten Linnarsson將激光顯微切割技術與大規模RNA測序相結合,對小鼠的內側神經節突起進行了空間相關轉錄組分析,他們在中間神經元成熟的過程中發現了有明顯差異的祖細胞群,這揭示了哺乳動物中樞神經系統的基因表達的空間異質性[42]。2016年,中科院上海細胞與生化研究所的景乃禾團隊利用激光顯微切割技術從小鼠的單個胚胎中分離出目標位置的細胞群,進行了單細胞RNA測序,揭示了小鼠胚胎原腸胚期的空間轉錄組信息和細胞身份[43]。
激光顯微切割原理
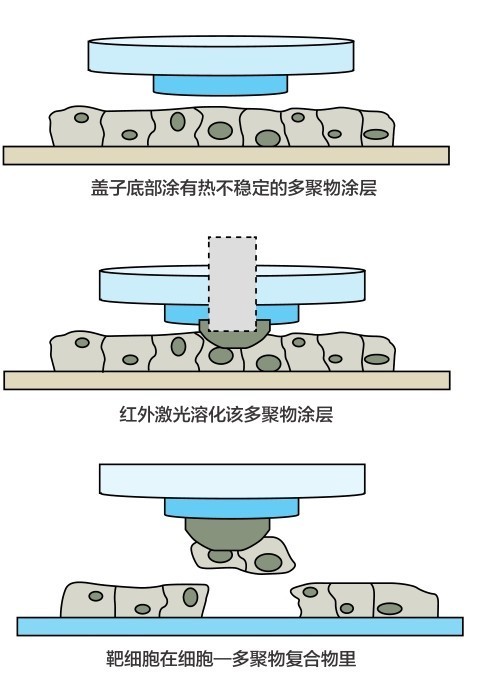
「古老」的原位螢光雜交技術也在單細胞化,並且與測序相結合。2014年,加州理工的Long Cai提出了螢光原位測序技術,它能夠對還在組織或培養基中的細胞利用第二代測序直接進行測序。整個技術的基礎是一種新型的核酸文庫構建技術,這種技術能夠在生物組織內進行穩定的交聯c DNA擴增[44]。通過高強度的顯微觀測、生化處理、圖像處理以及生物信息學分析,人們最終可以得到目標細胞的測序序列。2015年,哈佛大學的莊小威團隊在《科學》雜誌上發表了他們關於在單細胞中進行高度復用的空間解析RNA圖譜的研究。他們發表了一種名叫MERFISH(多重抗誤差原位螢光雜交)的技術,能夠在單細胞中實現數千條RNA的拷貝數和空間定位的成像[45]。
螢光原位測序技術將空間相關的RNA-FISH技術和全轉錄組RNA圖譜技術相結合,通過單個分子原位RNA定位來保持組織的形態。使用螢光原位測序,讓分析不同空間分佈或拷貝數變化的單個細胞轉錄組成為可能,這些分析能夠協助描述組織中複雜的調解網絡以及細胞類型的原位鑒定。
大多數的人體組織較厚,而且不透明。那麼有沒有一種方法讓人們能夠在保持組織原樣的同時,對特定細胞進行定位和觀察呢?2013年4月,斯坦福大學的Karl Deisseroth在《自然》雜誌上發表的Clarity技術,可以使小鼠組織透明化[46]。通過Clarity,人們能夠在器官中定位目標細胞的三維位置。Clarity的誕生使人們走進了器官圖像分析的新紀元,改變了人們對器官內部的認知。

結合組織學和化學工程的工具,研究者們開發了一套不通過切割小鼠的大腦便能解析其三維複雜性和分子表達的方法。整個技術的核心是將小鼠大腦中的脂質置換成水凝膠聚合物。將小鼠的大腦放置於水凝膠單體的懸浮液後,大腦本身就會通過一種類似於石化的過程產生水凝膠聚合物,而且這種聚合物不會和脂質相結合。將脂質通過電泳過程移除之後,就會留下一個三維透明的大腦,且保留了所有的重要結構,如神經元、軸突、樹突、突觸等。
Clarity使人們能夠對大腦進行完整的細節化的結構研究,對於瞭解健康和疾病狀況下的大腦功能具有重要的意義。目前,Clarity已經被用於小鼠的大腦、胰腺、腎臟、肺、腸道和肝臟的研究中,但是對於具有很多非細胞基質組成的器官(如皮膚、齒齦等)的研究,Clarity仍具有局限性。
除了上述技術,神經科學研究者也將神經科學常用的電生理技術與測序相結合。膜片鉗測序(Patch-Seq)在2015年由貝勒醫學院和卡羅琳斯卡學院的Andreads Tolias和Rickard Sandberg共同發表在《自然·生物技術》雜誌上[47]。在過去的幾十年中,科學家們一直在利用一種叫作全細胞膜片鉗的技術來測量神經細胞的電活動,比如神經元產生神經衝動時的獨特的電位變化。然而,每個神經元之間的基因表達水平是不同的,之前並沒有能夠將單細胞的基因差異和膜片鉗記錄相結合的研究方法。在很長的一段時間內,想要研究神經元的細胞生理活動和基因表達之間的關係是一件很困難的事情。
Pathc-seq是一項將膜片鉗記錄與單細胞RNA測序相結合的技術,能夠被用於同時研究單個神經元的形態學、生理學和基因表達圖譜等。通過追蹤電生理特徵,研究者可以偵探到具有特點的目標細胞,隨後用膜片鉗吸管將細胞內容物吸出,進行RNA測序。對於神經細胞研究而言,Patch-Seq技術能夠對目標細胞進行精確的內容物提取以研究神經元的多樣性,對神經系統中複雜的細胞類型的分類研究有極大的幫助。
細胞圖譜的意義重大,可以說是繼人類基因組測序之後的又一個「兵家必爭之地」。現在的局面是頂尖研究所三足鼎立:桑格研究所、布羅德研究所和新秀Biohub。
桑格研究所是一家位於英國的研究機構,其利用基因組測序技術來推動人類對生物和疾病的認知,以改善人類的健康。1993年10月4日,當時還被稱為「桑格中心」的桑格研究所在英國創立,創立之初,整個機構僅有不到50名員工,如今所有園區的員工數量已經超過3000人。以建設大規模的世界級研究中心為目標,桑格研究所用20多年的時間,從最初的測序中心發展到基因組研究領域的行業領先機構。作為一家在遺傳學領域世界領先的研究機構,桑格研究所旨在對人類病原生物學研究提供能夠改變目前生物醫學現狀的思想[48]。
桑格研究所的細胞遺傳學研究項目側重於探索人類細胞中的基因組差異,以及在健康和疾病狀況下的基因功能變化。他們實施了一個大規模的系統化基因篩選,目的是探索在自然狀況和人工編輯狀況下人類誘導多功能幹細胞的基因變化,以及它們的分化衍生過程和其他細胞類型[49]。目前,這個項目正在研究參與感染、先天性免疫、代謝過程的細胞類別(如巨噬細胞、肝細胞、胰島B細胞等),並且正在計劃開展一項全面反映人體內細胞類別和功能的研究項目,以幫助人們更深入地瞭解、診斷、治療、監測人類疾病。
細胞遺傳學項目將使用來自已知健康狀況的100多名受試者的多功能誘導性干細胞,使其分化為巨噬細胞、肝細胞、胰腺細胞等。通過分化後的細胞探索在宿主與病原之間的相互作用、先天性免疫反應、代謝反應過程中的細胞水平的變化。研究者們將來自細胞遺傳學的結果和來自功能基因組學的數據相結合,利用創新型的算法來研究基因調控的機理,以幫助解釋疾病之間的差異。利用單細胞研究的技術,科學家們計劃建立一個全面反映人體內每個細胞的表觀遺傳學和轉錄組學的參考遺傳圖譜。同時,他們還計劃開發一項基於Crispr-Cas系統來全面檢測基因組層面的編碼蛋白基因和長鏈非編碼蛋白RNA的技術,以探索基因組成分對細胞表型的影響。這項計劃將開發和改善一系列創新性的工具,以更加全面地分析單細胞研究的數據。
位於美國波士頓劍橋的布羅德研究所是細胞圖譜計劃的發起者之一。布羅德研究所起源於來自哈佛大學和麻省理工學院的科學家們數十年的非官方合作。1995年年初,來自麻省理工學院懷特海德研究所的科學家們意識到將遺傳學應用於人類疾病研究的必要性,這促成了一些遺傳性醫學研究的初始項目,也促使哈佛大學和麻省理工學院在癌症和人類遺傳學方面開拓新方法的科學家們形成了一套高效的合作網絡[50]。隨後,1998年哈佛醫學院成立了化學與細胞生物研究所(ICCB),以幫助實現將化學基因組作為未來瞭解人類生物學和疾病的工具的目標。
這些項目說明了具有不同背景的研究者齊心協力解決分子醫學問題中的重大挑戰的重要性。由此可見,一個新型的正式的合作機構是十分必要的,它需要具有開放、合作、多學科交叉、能夠組織任何規模的科研項目的特點。更重要的是,哈佛大學和麻省理工學院的遺傳學家和生物化學家們能夠互補合作,將基礎的分子研究理論轉化為對人類疾病的新型研究。2002—2003年,創始人依萊、埃德斯·布羅德和哈佛大學及附屬醫院、麻省理工學院、懷特海德研究所的研究者們勾勒出了這個新型研究機構的雛形。2003年,在依萊和埃德斯·布羅德的捐贈下,布羅德研究所正式宣告建設,並於2004年5月建成。截止到2014年,布羅德研究所總計獲得超過了10億美元的捐款,成為生物醫學研究的領頭者。
布羅德研究所的人類細胞圖譜計劃把來自世界各地的生物學家、臨床醫師、物理學家、計算機科學家、軟件工程師和數學家們彙集起來。這些科學家們將各自不同的專業知識相互結合,為了一個共同的目標——建立全面的人類細胞遺傳圖譜而相互合作。只有建立了這個能夠解析不同細胞類型的圖譜,精確定位人體中的所有細胞,分析它們的基因表達水平,我們才能準確地描述所有的細胞活動,瞭解細胞網絡結構。一個全面的細胞圖譜使鑒定所有的細胞類類型(甚至亞型)、定位細胞的空間位置、區分不同的分化階段和細胞狀態成為可能;還使研究者能夠追蹤細胞譜系,比如追溯紅細胞在骨髓中的干細胞來源。細胞圖譜計劃將會幫助鑒定不同疾病的生物標記物和各類特徵,為各類療法提供新的靶點目標,為人類生物學研究提供一個全新的視角[51]。
2016年,Facebook首席執行官扎克伯格和他的妻子陳麗霞捐贈6億美元創立了Biohub,以推動加利福尼亞州灣區生物醫學的合作和發展。這是扎克伯格及妻子投資的第一項科學慈善機構[52]。新秀Biohub將融合來自加州大學伯克利分校、斯坦福大學和加州大學三藩分校的科學家們來推動人類疾病的研究。Biohub的創立目標是幫助治癒、預防、操控人的一生中所有的疾病,創立未來生命科學研究的新藍圖。所有Biohub的科學家、研究院和工程師們將嘗試破解人類疾病的複雜性,並為治癒疾病提供新的方法。除了合作和科學研究之外,Biohub的另一個使命是培養青年科學家成為行業的領頭人。
扎克伯格和他的妻子陳麗霞將細胞圖譜研究作為其30億美元醫療研究捐贈的首個目標。人類細胞的未解之謎是很多疾病發生的根源, Biohub的細胞圖譜項目將通過研究健康人類中細胞工作的方式,嘗試揭開這些謎團。其研究的重點更加側重於在疾病發生時這些細胞發生的反應,以描述細胞在疾病刺激下的內部機理變化[53]。
讓我們期待細胞圖譜為醫學科學帶來新的突破!
專家點評
徐迅
華大基因研究院院長,國家基因庫執行主任。
細胞是組成生命的最基本單位。人體細胞究竟有多少種類,不同種類的細胞如何實現不同的功能,當疾病發生時這些細胞發生了什麼樣的改變?現有的知識將細胞分為400多種,但究竟有多少種誰也說不清楚。隨著單細胞技術,尤其是大規模單細胞測序研究的開展,越來越多的新的細胞亞型被鑒定出來。人體細胞圖譜計劃試圖在基因表達水平精確地定義人體的每一個細胞,如同人類基因組計劃那樣全面透徹地解讀人體細胞「天書」。
第一個單細胞轉錄組研究是採用微陣列芯片技術完成的,而第二代測序技術的出現使轉錄組研究進入了一個被稱為「RNA測序」的階段。從2009年至2017年將近8年的時間裡,單細胞轉錄組技術飛速發展,特別是基於納米微升的droplet技術將單細胞RNA測序的成本降低到一個市場可以接受的水平。就是在這樣的背景下,桑格研究所和布羅德研究所牽頭發起了「人體單細胞圖譜」計劃,並且獲得了Chan Zuckerberg Initiative基金會的大力支持。據悉,第一批資助計劃將很快進入實際申請階段。
儘管人體單細胞圖譜計劃還處在孕育的早期階段,但我們已能觸摸到即將帶來的巨大變革,而這個變革將不亞於人類基因組計劃。首先,疾病的診斷模式將迎來全新的飛躍。人體單細胞圖譜提供了健康人的完整細胞目錄,而疾病細胞通過單細胞RNA測序找到的與「已知目錄」的差異信息將成為疾病診斷的重要線索,最終迎來一個「人體疾病細胞圖譜」,讓疾病能夠在更早期就被診斷出來。其次,藥物研發的速度將加快而成本將下降。對於已知靶點的藥物,借助人體單細胞圖譜的信息,將更容易通過大數據方式預測該藥物的副作用,甚至針對特定病人精確地預測其是否有可能出現嚴重的諸如肝腎功能衰竭等副作用。
人體單細胞圖譜是一個極其「大膽的」計劃,想要切實落實並最終獲得高質量的圖譜,仍面臨許多挑戰。眾多的世界頂尖的實驗室將加入其中,如何建立標準化的操作流程,使來自不同實驗室的數據可以有意義地被整合,是首當其衝需要解決的問題。
專家點評
曹虎
科特勒咨詢集團(KMG)中國區總裁。
「如果你想用一個世紀的時間來尋找治療疾病的方法,最好先把重點放在基礎研究上,因為你根本無法預測這些治療方法從何而來!」科學慈善聯盟主席(Science Philanthropy Alliance) Marc Kastner在給CZ Biohub的建議中如是說。而且Chan 和Zukerberg接受了這個建議,並且制定了一個宏偉的計劃:人類細胞圖譜(Te Cell Atlas),旨在對人體內的每一種細胞進行單細胞測序,描繪其分子特徵。作為一個開源的項目,人類細胞圖譜產出的數據將向所有研究者開放。它顯然將對新藥的研發、新治療手段的產生發揮重要的促進作用,同時在這個項目的開展過程中產生的新技術很可能開啟很多基礎研究和臨床研究的新篇章。
從技術上看,今天的單細胞測序技術仍然面臨著至少4個方面的挑戰:有效的單細胞分離;基因組擴增;測序價格;有效的數據解讀。雖然單細胞測序已經在輔助生殖領域進入了初步的臨床應用階段,但是目前的數據準確性、檢測週期和價格都還是臨床推廣的瓶頸。CZ Biohub的聯席主席斯蒂芬·夸克(Stephen Quake)顯然是這個領域的翹楚。夸克將利用細胞微流體進行單細胞分離;利用超快、高效的測序儀,極大地降低測序成本、極快地提升測序速度;使用基因組編輯(如CRISPR)進行單細胞的標記和追蹤技術,基於基因活動來定位人體器官中的各種細胞。相信這些技術將在項目的推進過程中逐漸迭代,將來很有可能發展成適合在臨床開展的臨床檢測項目,滿足目前無法滿足的臨床需求。比如目前在腫瘤的液體活檢領域,CTC(循環腫瘤細胞)已經作為成熟的檢測手段用於腫瘤的復發監控。但是目前還沒有辦法分析CTC的基因組,瞭解其異質性並針對其突變情況精準用藥。而用於人類細胞圖譜的技術將滿足這個臨床的需求。再如,目前很多的腫瘤患者無法判斷其原發灶的組織來源,通過對腫瘤患者進行單細胞測序,檢索人類細胞圖譜,臨床醫生將很容易判斷腫瘤細胞的來源並制定更精準的治療方案。在遺傳疾病領域,我們已經知道很多遺傳疾病存在基因嵌合的現象。夸克位於斯坦福大學的實驗室最近就發現了由於SCN5A基因嵌合導致的長QT 綜合征。
正如17年前的人類基因組計劃催生了今天正在蓬勃發展的精準醫療產業,人類細胞圖譜必將把基礎研究、新藥研發、臨床研究和分子診斷帶入一個全新的境界。
專家點評
田埂
元碼基因聯合創始人,曾任清華大學基因組與合成生物學中心主管,華大基因華北區第一負責人,天津華大創始人、總經理,深圳華大基因研究院研發副主管。
意義堪比人類基因組計劃的人類細胞圖譜項目,將破譯出人體中每個細胞的類型和特性,構建健康人體的參考圖。人類細胞圖譜是生命科學領域很長一段時期以來最為振奮人心的提案。對於健康和疾病而言,細胞是生命最基礎的組成部分,只有對細胞有清晰的瞭解,才能夠瞭解病理機制,提供有效的治療方案。這一項目的完成對整個人類來說無疑具有非常重大的意義,它使人類向真正的「個性化醫療」時代又邁進了一步。
細胞圖譜項目是醫學上一場革命的開始,但這場革命的成功將需要更長的時間。有可能「理想很豐滿,但現實卻很骨感」。單從技術層面上看,不斷發展的科學技術完全可以支持細胞圖譜繪製的實現,如細胞微流體、高效的測序儀和先進的標記及染色技術等。從經濟角度上看,現在的測序成本已經低至1個細胞6美分,人類對自身研究的需求遠遠可以讓這個價格顯得微不足道。
細胞圖譜是一項基礎工程,對於這項技術的複雜度和工作量,不同的科學家在認識上還存在著一些分歧。有的科學家認為人體內細胞的種類和數目繁多,有的還存在眾多亞型,使得人類細胞圖譜項目比人類基因組計劃有更多的未知難度和更大的工作量。對此我們則持樂觀的態度,「莫道浮雲遮蔽日,嚴冬過盡綻春蕾」,實驗科學永遠要在做了之後才能真正地挖掘出意義。細胞圖譜對於科學體系與細胞機制的推動會在未來百年之內不斷發酵和沉澱。我們相信,通過完成這項有著革命性意義的工作,會讓人類細胞圖譜項目成為21世紀最耀眼的註腳之一。
